CUSTOMER CENTER
CIRS는 기업이 만들어내는 안전한 제품 개발을 돕는 인증 · 검사 서비스를 제공하고 있습니다.
CIRS는 기업이 만들어내는 안전한 제품 개발을 돕는 인증 · 검사 서비스를 제공하고 있습니다.
코로나19 바이러스가 인체에 침투하면 인체는 방어하기 위해 상응하는
특정 항체를 생성한다. 이 중 특이성 항체인 IgM이 가장
먼저 생성되어 초기 방어를 하는데 이 항체는 유지기간이 짧고 소실 속도가 빠르며 혈액에서 수일에서 수주간 지속된다. 이후 IgG 항체가 생성되며
IgM이 소실될 때 IgG의 함량이 최고조에 도달하고 혈액에서 더 오래 지속된다. 임상 적용에서 COVID-19 특이적 IgG의 검출률은 바이러스 감염 초기에 낮기 때문에 이 마커는 COVID-19
감염의 보조 진단에 단독으로 사용되지 않으며 COVID-19 특이적 IgM 항체 검출과 함께 사용해야 한다.
1. 코로나19 항체검출시약 임상시험 가이드라인 및 기준
일련번호 | 가이드라인/표준명 | 발표 시간 |
1 | 체외진단시약의 등록 및 제출에 관한
행정조치 (국가시장감독관리총국령 제48호) | 2021-08-31 |
2 | 신종 코로나바이러스(2019-nCoV) 항체검출시약 등록심사 가이드라인 | 2022-04-27 |
3 | 체외진단시약 임상시험 기술지침' | 2021-09-16 |
4 | 신종 코로나바이러스 감염증의 폐렴 진료
방안 | 2022-03-15 |
5 | 신종 코로나바이러스 감염을 위한 폐렴
실험실 검사 기술 지침 | 2020-09-16 |
2. 임상시험 요건
카테고리 | 특정 요구 사항 |
기구와 윤리적 요구사항 | (1) 코로나19 항체검출시약의 임상시험은 필요에 따라 3개 이상(3개 포함)의
임상시험기관에서 실시하여야함. |
(2) 임상시험을 수행하는 기관은 필요에 따라 국가약품감독관리국 의료기기 임상시험 기관 등록 시스템에 등록하여야
함. | |
(3) 윤리위원회 또는 지역윤리위원회가 있는 경우 윤리승인서류 제공(신고
전 까지만 가능) | |
(4) 윤리위원회가 없는 경우 기관은 윤리위원회가 없는 성명을 발표하고 해당 기관에서 임상시험을 수행할 수
있음을 선언하여야 함. | |
(5) 주의 사항: 지정된 병원,
대상 모집단, 충분한 표본 크기, 확진 및
제외 사례가 모두 포함됨, 사례 배경 정보가 완전하고 이용 가능함,
임상시험 윤리 및 서명에 협조할 수 있음. | |
임상시험 설계 요구사항 | (6) 연구 유형: 이 유형의 제품의 예상 사용은 일반적으로 신종
코로나바이러스로 인한 폐렴의 보조 진단이며 임상 시험은 관찰 연구임. |
(7) 연구 방식(두 가지): | |
(8) 주의사항: ② 임상시험 에서 임상표준품과의 비교연구를 선택하는 경우, 임상시험은 신종 코로나바이러스감염증 폐렴의 임상진단기준과 비교를 위한 질병진행과정의 판단결과를 선정하여야
함. 항체 검출 시약의 임상 성능을 충분히 평가할 수 있도록 진단에 사용되는 핵산 검사 결과를 동시에
참조하는 것이 좋음. | |
피험자 요구사항 | (9) 임상시험에 참여하는 그룹은 코로나19 백신을 접종하지 않았거나
이전에 코로나19에 감염된 적이 없는 의심환자에 사용함. |
표본 크기 요구 사항 | (10) 표본은 두 종류로 나뉜다. |
임상평가자료 형식 및 요구사항 | (11) 신청인은 관련 규정 및 문서의 요구 사항에 따라 임상 평가 요약, 각
기관의 윤리 검토 의견, 임상 시험 계획서, 임상 시험
요약 및 임상 시험 요약 보고서를 제출해야 한다. |
12) eRPS 제출 요구에 따른 자료 준비 | |
임상시험 데이터 요약표 | (13) 임상시험 데이터 요약표는 임상시험 보고서의 부록으로 제출한다. |
3. 임상시험자료 요약표
피험자 | 연령 | 성별 | 샘플 유형 | 확인/제외
결과 | 임상 진단 배경 정보 | 시약 검사 결과 심사 | 핵산 검사 결과 | 샘플링 시간 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
비고: | ||||||||
첨부
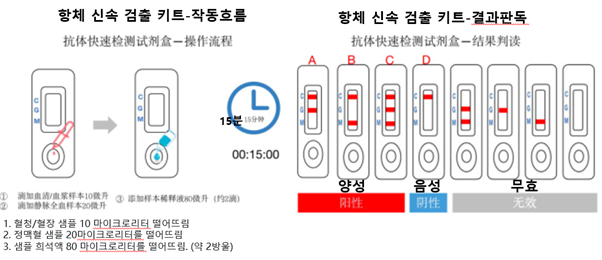
결과판독해석
|
A |
IgM 음성 + IgG 양성 |
양성 , 이전 감염 |
|
B |
IgM 양성 + IgG 음성 |
양성 , 초기 감염 |
|
C |
IgM양성+IgG양성 |
양성 , 현재 감염 |
|
D |
IgM 음성 + IgG 음성 |
정상 |